Medicina genómica a la carta
El genoma humano se caracteriza por presentar una gran heterogeneidad en sus secuencias, y dicha variedad está correlacionada con la riqueza en genes. La variación estructural del genoma humano implica numerosas deleciones, duplicaciones, inserciones, inversiones y complejas combinaciones de reordenamientos que a su vez involucran desde kilobases hasta megabases. Además, se sabe que estos fenómenos son mediadores de una amplia gama de enfermedades o a la susceptibilidad de otras muchas alteraciones. En la actualidad, se están realizando estudios de genómica comparada a partir de genomas de individuos provenientes de todo el mundo, los cuales están aportando información muy relevante y precisa.
En algunos casos, los genes individuales aparecen en copias múltiples debido a duplicaciones de segmentos de ADN. En otros, segmentos de ADN se aprecian en algunas personas pero no en otras, lo que significa que el genoma humano establecido por el Proyecto del Genoma Humano estaría incompleto. Estos cambios estructurales pueden influir tanto la capacidad para desarrollar patologías como el normal desempeño o el mismo aspecto de nuestro cuerpo. Por ejemplo, la ceguera al color, el mayor riesgo al cáncer de próstata y la susceptibilidad a algunas formas de enfermedades cardiovasculares resultan de deleciones de genes particulares o de partes de genes. Copias adicionales de un gen conocido como CC3L1 reducen la posibilidad de una persona a la infección por el VIH y a la progresión al SIDA. Cantidades menores de lo normal de otros genes pueden llevar a alteraciones intestinales o renales.
Variaciones de la estructura genómica
El objetivo final de la medicina personalizada es identificar las diferencias genéticas entre las personas y correlacionar las características genéticas específicas (o una combinación de características) con la diferencia de riesgo de enfermedades humanas o la eficacia de determinadas intervenciones terapéuticas. Esta meta se puede lograr cuando se es capaz de identificar todas las formas de variación genética en cada una de las personas e interpretar esta información de una manera clínicamente significativa.
El Proyecto del Genoma Humano reveló un alto grado de similitud entre las secuencias de ADN de dos personas diferentes. Estas semejanzas nos unen como especie. Por otra parte, las diferencias en las secuencias de nuestro ADN (combinada con los efectos del medio ambiente) hacen que cada uno de nosotros sea único. Hasta hace poco, las diferencias cualitativas en el genoma - en forma de polimorfismo de un solo nucleótido - han estado en primera plana de la actualidad científica. Sin embargo, un reciente estudio realizado por Jan O. Korbel y colegas del Laboratorio de Biología Molecular Europeo en Heidelberg, Alemania, refuerza la idea de que las diferencias cuantitativas, tales como la deleción y duplicación de secuencias genómicas, y los reordenamientos a gran escala (colectivamente denominados como variación genómica estructural) son tan o más relevantes.
El grupo de J. O. Korbel desarrolló una estrategia experimental y computacional para obtener una visión de la arquitectura de la variación genómica estructural de dos personas. Ellos lo lograron tomando el total de ADN de cada una de estas personas, copiaron los fragmentos de alrededor de 3 kb, secuenciaron al azar los extremos de decenas de millones de estos trozos, y luego compararon los pares de las secuencias obtenidos de cada fragmento de ADN con la secuencia de referencia, dada a conocer por el Proyecto del Genoma Humano.
Los autores identificaron 761 variaciones estructurales en una sola persona y 887 en la otra. Aproximadamente el 65% de las variantes identificadas fueron de menos de 10 kb, y el 15% eran mayores de 100 kb. Por lo tanto, parece probable que la variación genómica estructural contribuye más a la heterogeneidad genética que los polimorfismos de un solo nucleótido, con varios millones de bases de las variantes genéticas que diferencian los genomas de dos personas. Además, y en consonancia con estudios previos, muchos de los genes afectados por las variantes fueron genes "sensor ambiental" (es decir, los genes que modulan las interacciones con el medio ambiente, incluidos los que participan en la inmunidad y la percepción de los sentidos). El efecto funcional de la diversidad genética no se limitó a la presunta diferencia de los niveles de expresión génica debido a diferentes copias, sino que se relacionó también con la inversión de ciertos genes, las supresiones específicas que afectan a los exones o intrones, e incluso la creación de nuevos productos de fusión génica.
Esta prueba de principio mostró elegantemente una forma de análisis del genoma en su conjunto, que identificó con precisión las variaciones estructurales. Sin embargo, surgieron varios obstáculos entre el conocimiento del genoma de una persona y la práctica de la medicina personalizada. En primer lugar, toda la información sobre la secuenciación del genoma se debe obtener de manera más eficiente y eficaz en función del costo. La estrategia utilizada por la unidad de Jan O. Korbel actualmente requiere de 8 meses de uso continuo de un equipo de secuenciación de ADN, a un costo de más de 200.000 dólares, para obtener los datos sobre la variabilidad genómica descrita en este artículo. Evidentemente, esta cantidad de inversión dificulta el análisis de rutina. En segundo lugar, la variación genética humana, incluyendo la menor frecuencia alélica de las variantes, debe ser catalogada de forma más amplia. Para alcanzar este objetivo, se están aplicando diversas técnicas de asociación genómica amplia (en inglés, genome-wide association) para la identificación y caracterización de polimorfismos de un solo nucleótido y las variantes genéticas en el ADN de miles de personas sanas en todo el mundo. Con estos catálogos de variaciones genéticas humanas, de casos y controles y de estudios de asociación basados en la familia se puede llevar a cabo la correlación de variantes genéticas específicas con rasgos humanos, incluido la susceptibilidad diferencial a las enfermedades más comunes. De hecho, este tipo de asociaciones ya están comenzando a describirse para una amplia gama de condiciones humanas.
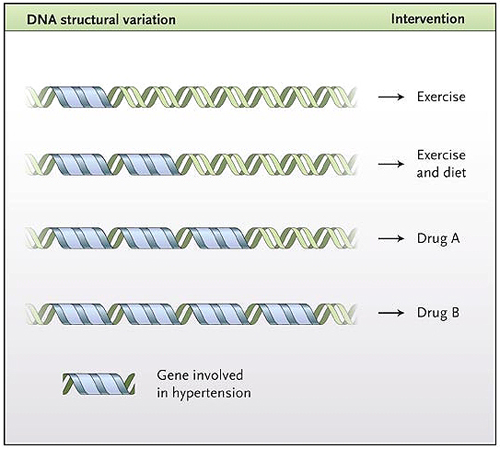
En este modelo, a través de un escenario hipotético, cuatro enfoques para el tratamiento de la hipertensión dependen del número de copias de un gen que confiere el riesgo de hipertensión arterial y que son transportadas por la persona afectada. La mejor intervención clínica para una persona con una, dos, tres o cuatro copias de este gen será el ejercicio, el ejercicio y la dieta, la administración de un fármaco A o la administración de un fármaco B, respectivamente.
Los médicos pueden eventualmente ser capaces de utilizar una variación genética personal para determinar el perfil óptimo de intervención para la condición de un paciente (figura 1), aunque tal estrategia dependerá de la información genética entregada por los ensayos clínicos. Por supuesto, seguirá siendo una lucha para proporcionar este tipo de información de forma que un paciente y un médico puedan tomar decisiones relacionadas con la salud y reducir al mínimo sus efectos sobre la discriminación en materia de seguros. No obstante, en la actualidad asistimos a un excitante descubrimiento de la genética humana que sin duda afectará a los médicos y a la práctica de la medicina de manera definitiva.
Fuente bibliográfica
Structural Genomic Variation and Personalized Medicine
Charles Lee, Ph.D., and Cynthia C. Morton, Ph.D.
Department of Pathology, Brigham and Women's Hospital, Harvard Medical School, Boston, USA.
N Engl J Med. 2008 Feb 14;358(7):740-1


