Los pecados del receptor X del hígado
Los receptores nucleares hepáticos constituyen una superfamilia de factores de transcripción dependientes de ligando que regulan diferentes elementos de la homeostasis y el desarrollo. Dos de los miembros de esta familia, LXR (siglas en inglés para Liver X Receptor) alfa y beta, ejercen importantes acciones en el equilibrio de los lípidos. Están regulados por determinadas formas oxidadas del colesterol y por productos intermediarios de la vía del colesterol. Además, algunos de sus genes participan activamente en procesos de transporte reverso del colesterol desde los tejidos periféricos hasta el hígado. Esta acción es relevante en la prevención de la formación de células espumosas a partir de macrófagos residentes en la pared arterial. De hecho, los agonistas sintéticos LXR se han utilizado en modelos murinos para proteger contra la aterosclerosis.
La importancia fisiológica de los LXR en el metabolismo lipídico y del colesterol sugiere que pueden influir en el desarrollo de trastornos metabólicos como la hiperlipidemia y la aterosclerosis. La evidencia de esta idea ha sido observada en recientes estudios que vinculan la actividad de LXR a la patogénesis de la aterosclerosis. Por ejemplo, los ratones knock-out para LXR alfa suelen ser sanos cuando son alimentados con una dieta baja en colesterol, sin embargo, desarrollan hígado graso, degeneración de las células hepáticas, niveles altos de colesterol y la alteración de la función hepática cuando son alimentados a base de un régimen hipercolesterolémico. Al contrario, los animales knock-out para LXR beta no se ven afectados por la alta ingesta de colesterol, lo que sugiere que LXR alfa y LXR beta poseen funciones independientes. Los LXR también regulan la homeostasis de los lípidos en el cerebro en ratones knock-out tanto para LXR alfa como LXR beta desarrollan cambios neurodegenerativos en el tejido cerebral.
En modelos murinos, los agonistas de LXR han demostrado ser eficaces para el tratamiento de la arteriosclerosis, la diabetes, la inflamación y la enfermedad de Alzheimer. Su uso (hipocolamida, T0901317 o GW3965) disminuye los niveles de colesterol en el suero y en el hígado e inhibe el desarrollo de procesos ateroscleróticos. El agonista sintético GW3965 mejora la tolerancia a la glucosa y la resistencia a la insulina mediante la regulación de genes implicados en el metabolismo de la glucosa hepática y el tejido adiposo. GW3965 inhibe la expresión de mediadores inflamatorios en cultivos de macrófagos y la inflamación en ratones. Los agonistas T0901317, 22R-hidroxicolesterol y 24S-hidroxicolesterol también han demostrado suprimir la proliferación del cáncer de próstata y de mama, y en particular T0901317, disminuye la producción de la proteína beta amiloidea en modelos animales diseñados para el estudio de la enfermedad de Alzheimer. Sin embargo, tanto T0901317 como GW3965 aumentan también los triglicéridos plasmáticos y en el hígado en otros tipos de ratones, lo que indica que no pueden ser buenos candidatos para agentes terapéuticos.
El receptor X hepático y la aterosclerosis
Las enfermedades cardiovasculares son la principal causa de muerte en el mundo desarrollado, y se convertirán en el problema de salud más extendido en toda la tierra. A su vez, la aterosclerosis es el primer motivo de patologías cardiovasculares. Un elevado nivel plasmático de las lipoproteínas de baja densidad (LDL) es la condición sine qua non para el desarrollo de la aterosclerosis. Las personas que en el transcurso de su vida se han mantenido con concentraciones bajas de colesterol LDL no tienen mayor riesgo de enfermedades cardiovasculares, sin embargo, su drástica reducción mediante el uso de estatinas durante varios años reduce el riesgo de ataque al corazón en sólo un 40%, en gran medida debido a que la enfermedad ya está establecida cuando el tratamiento se ha iniciado. El manejo temprano y prolongado con estatinas podría reducir aún más este riesgo, pero nuevos esquemas medicamentoso son necesarios.
En consecuencia, se ha fortalecido fuertemente la búsqueda de nuevos principios dirigidos contra los mecanismos aterogénicos básicos, pero el camino hacia éstos ha estado lleno de fracasos que le han costado a la industria farmacéutica miles de millones de dólares. Los elementos básicos del problema son las presiones de las grandes empresas farmacéuticas, recursos insuficientes de los organismos reguladores y una pobre comprensión de los procesos biológicos que son objetivos de los nuevos fármacos y sus mecanismos de acción. Un reciente estudio de Michelle N. Bradley y colaboradores, proporciona una novedosa idea, aunque no tan nueva, pero por lo por tanto, bienvenida.
El colesterol es un componente necesario de las membranas celulares, precursor de los ácidos biliares y constituye la materia prima para la síntesis de las hormonas esteroides. La homeostasis del colesterol es altamente susceptible a la saturación en la dieta occidental y a los trastornos genéticos, lo que perturba el metabolismo de la molécula. Se ha observado que los niveles del colesterol LDL en adultos superan en gran medida a los de los recién nacidos y al de los animales en estado salvaje.
La aterosclerosis es una inflamación crónica en la íntima arterial y se desarrolla lentamente a lo largo de los años. Es el resultado de la interacción entre el colesterol LDL, monocitos y macrófagos, las células T y la musculatura lisa de la pared arterial. El colesterol es el sello y el agente provocador de la aterosclerosis. Las primeras lesiones de la enfermedad, denominadas vetas de grasas ya se pueden detectar en la primera década de la vida y corresponden a acumulaciones denominadas “células espumosas” (macrófagos que han fagocitado colesterol) en la íntima de las arterias. En estados avanzados de las placas de ateroma, las células espumosas sufren apoptosis, lo que hace que las placas se rompan y de ese modo se favorezca la trombosis vascular.
En el organismo, los receptores X hepáticos alfa y beta (LXR alfa y LXR beta) son los principales reguladores de la homeostasis del colesterol, del metabolismo intermediario y el balance de energía, y de la integración de las señales inflamatorias y metabólicas. El metabolito del colesterol, el oxisterol, es el ligando natural para la activación de los LXR, siendo un heterodímero formado por LXR alfa o LXR beta, más un receptor retinoide X (RXR). El LXR alfa y el LXR beta tienen diferentes expresiones que son específicas a los tejidos, interaccionan con coactivadores y correpresores, y por supuesto, con importantes mecanismos (Figura 1). Estas diferencias generan diferentes formas de activación génica. El LXR beta se expresa ubicuamente, mientras que LXR alfa lo hace predominantemente en los tejidos que participan en la homeostasis de los lípidos en el hígado, intestinos, tejido adiposo y macrófagos. LXR alfa y LXR beta son igualmente eficaces en la promoción del transporte inverso del colesterol desde los macrófagos, ellos activan a los miembros de la superfamilia ABC (ATP-Binding Cassette) de los transportadores de membrana, los cuales transfieren el colesterol a las partículas de lipoproteína de alta densidad (HDL). También reprimir los genes implicados en la señalización de los macrófagos inflamatorios y en la apoptosis. Los LXR alfa y LXR beta igualmente son capaces de activar los genes (por ejemplo, el gen de la glucoquinasa) que participan en el metabolismo de la glucosa. La relación macrófago-LXR y la inhibición de la aterosclerosis, se ha convertido en una atractiva meta para el descubrimiento de nuevos medicamentos.
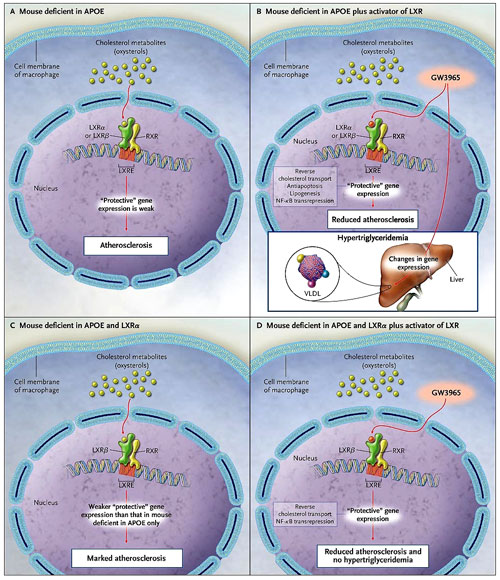
En estado basal, los receptores X del hígado (LXR) y los heterodímeros receptores de retinoide X (RXR) están vinculados a los elementos de respuesta X hepática (LXRE) en los promotores de los genes objetivos. La activación del ligando conduce a células específicas, el objetivo de la expresión génica. Desarrollo de aterosclerosis en ratones deficientes para apolipoproteína E (APOE) (panel A). En estos modelos, el agonista dual LXR, GW3965, induce a los macrófagos la liberación del colesterol (por acción directa) y reprime los genes pro-inflamatorios en macrófagos (por indirecta "transrepresión" de factor nuclear kB [NF-kB] por un mecanismo nuclear presumiblemente desconocido), lo cual inhibe la aterosclerosis, pero también induce la lipogénesis y la secreción en el hígado de las lipoproteínas de muy baja densidad (VLDL) ricas en triglicéridos (panel B). Bradley y colaboradores recientemente han demostrado que una marcada aterosclerosis se desarrolla en ratones "doblemente" deficiente en APOE y en LXR alfa (panel C); esta forma de aterosclerosis es reprimida por GW3965. En contraste a sus efectos en ratones con receptores LXR alfa intactos, GW3965 no induce hipertrigliceridemia en estos animales (panel D), indicando que LXR beta es un candidato diana y altamente selectivo, de los medicamentos para tratar la aterosclerosis.
La primera generación de ligandos LXR alfa y LXR beta sintéticos no selectivos inhiben la aterosclerosis en ratones deficientes en apolipoproteína E, pero aumentan la lipogénesis hepática y los niveles de triglicéridos en el plasma (figura 1). En su estudio, el grupo de Michelle N. Bradley demostró que los ratones que carecen de LXR alfa y apolipoproteína E están protegidos contra la aterosclerosis por activación del ligando de LXR beta, quien activa el flujo de colesterol desde los macrófagos e incrementa los niveles de colesterol HDL; en donde los niveles de triglicéridos plasmáticos permanecieron normales. La observación altera la biología de los LXR y sugiere que la búsqueda de ligandos agonistas específicos de LXR beta para el tratamiento de la aterosclerosis puede resultar fructífera.
Esta estrategia, sin embargo, puede no ser tan sencilla, ya que los dominios para la unión de los ligandos de los heterodímeros LXR alfa - RXR y LXR beta - RXR son similares unos a otros. Dicho esto, se sienta un precedente respecto a los moduladores de los receptores nucleares, es decir, el tamoxifeno para el receptor estrogénico. Isoformas específicas de ligandos LXR están en desarrollo. Otros posibles beneficios de los agonistas de LXR podrían manifestarse en el sistema nervioso central: ellos han mejorado la enfermedad de Alzheimer en modelos de ratón, presumiblemente a través de sus efectos sobre el metabolismo del colesterol, la inflamación y la actividad de la gamma-secretasa.
Aunque el trabajo de Bradley y colaboradores apunta al LXR beta como un objetivo para el tratamiento de la aterosclerosis, los ratones y los seres humanos tienen diferentes expresiones génicas en respuesta a la activación de los LXR. Los genes involucrados en la producción de ácido biliar, en la respuesta inmune innata y en la lipogénesis hepática están regulados de manera diferente, tanto en ratones como en las personas. Estas diferencias pueden influenciar la eficacia y toxicidad de los ligandos de LXR en los humanos. Como observó Alexander Pope en su “Ensayo sobre el hombre” de casi 275 años atrás: "El estudio adecuado de la humanidad es el hombre”.
Fuente bibliográfica
The Liver X Receptor and Atherosclerosis
James Scott, M.B., B.S.
Imperial College, London.
N Engl J Med. 2007 Nov 22;357(21):2195-7


