Infecciones virales y protección cruzada, ¿bueno o malo?
Los mecanismos de defensa del huésped frente a agresiones externas y a la reparación de tejidos dañados están presentes de una forma u otra en todos los invertebrados. Estos sistemas constituyen la inmunidad natural o innata, también denominada inespecífica o de especie. A diferencia de esta forma de inmunidad, existen mecanismos de defensa más especializados en los cuales las moléculas extrañas inducen la producción de anticuerpos o citoquinas por medio de la selección clonal de los linfocitos B y T, respectivamente, que sólo se encuentran en vertebrados y constituyen la inmunidad específica o adquirida.
Aunque todos estos componentes son interdependientes, la inmunidad natural no es capaz de distinguir entre moléculas foráneas, por lo que su respuesta frente a éstas no se intensifica con sucesivas exposiciones, mientras que la inmunidad adquirida recuerda el encuentro con estos antígenos, haciendo que la réplica inmunológica se intensifique y sea más rápida con repetidas exposiciones a un mismo antígeno. La inmunidad adquirida ha retenido muchos de los mecanismos de la inmunidad innata que son necesarios para la eliminación de sustancias extrañas y ha añadido dos características importantes: la memoria y la especificidad.
Pero estos sistemas tienen sus caprichos. Todos los seres humanos se infectan con múltiples herpesviruses durante la infancia. Después de la infección aguda, el virus del herpes entra en un estado conocido como latencia. Este estado persiste durante la vida del hospedador y se ha visto que es parasitaria, ya que deja a la persona en situación de riesgo para su posterior reactivación viral y para enfermedades. En este sentido, la latencia del virus también confiere un extraordinario beneficio para el anfitrión. Se ha observado que ratones con infecciones latentes de gammaherpesvirus 68 o de citomegalovirus, que son genéticamente muy similares al virus de Epstein-Barr y al citomegalovirus humanos, respectivamente, son sorprendentemente resistentes a la infección de las bacterias Listeria monocytogenes y Yersinia pestis. Este tipo de protección no es antígeno-específica pero implica una producción prolongada de la citoquina antiviral interferón gamma y una activación sistémica de macrófagos. Por lo tanto, la latencia activa el estado basal de la inmunidad innata contra infecciones posteriores. Se ha especulado que la latencia del virus del herpes también puede participar en la respuesta inmunológica a los antígenos ambientales mediante el establecimiento de un entorno polarizado de citoquinas. Así, los nuevos datos sugieren que la latencia es una relación simbiótica con beneficios inmunológicos para el huésped.
Latencia viral y respuesta inmune
Los virus, como muchos microorganismos, tienen complejas y diversas relaciones con el sistema inmune. Necesitamos eliminarlos o controlarlos para sobrevivir como especie, pero bajo circunstancias especiales, son indispensables para obtener un nivel de protección contra otros gérmenes sin relación, tal como ha sido descrito recientemente por E. S. Barton y colegas (Nature 2007; 447:326-9).
Al sistema inmune tradicionalmente se le ha considerado único y altamente específico para el reconocimiento de proteínas, lípidos y de carbohidratos externos. Las respuestas de los anticuerpos son exquisitamente específicas. En medicina, nos aprovechamos de este alto grado de especificidad cuando utilizamos anticuerpos monoclonales para tratar desórdenes autoinmunes y ciertos cánceres. De una manera similar, las células T reconocen las singulares características químicas del antígeno del péptido para formar un complejo con las moléculas de histocompatibilidad. Los fagocitos y las células asesinas naturales (células del sistema inmune innato) representan otra importante rama de la inmunorespuesta celular. Estas células son la primera línea de protección contra la invasión de patógenos microbianos. Los fagocitos (como monocitos, macrófagos y células dendríticas) se pueden unir y obrar recíprocamente con diversos microorganismos, activar las células T a través del antígeno y convertirse en efectores microbicidas en respuesta a los citoquinas inflamatorias (figura 1).
Gracias a los primeros estudios de Koch en tuberculosis, se sabe que la respuesta del hospedador a los patógenos intracelulares se caracteriza por presentar macrófagos bactericidas altamente activados; tales tipos de células pueden eliminar varias formas de microorganismos. En sus clásicas investigaciones, George Mackaness (J Exp Med 1969; 129:973-92) estableció que la generación de macrófagos activados depende de los linfocitos, y generados una vez, éstos eliminan a muchos microorganismos, indicando que la etapa efectora no es específica al patógeno de incitación. Por ejemplo, los macrófagos activados que son inducidos por la salmonela pueden actuar sobre Listeria monocytogenes, otro patógeno intracelular, un fenómeno llamado protección cruzada. Esta relación bien orquestada y simbiótica entre el sistema inmune celular innato y el adaptativo ocurre de la siguiente manera: Las células T son reclutadas y activadas por los macrófagos a través de la presentación del antígeno, que induce a las células T para liberar el interferón gamma. El interferón secretado activa recíprocamente a los macrófagos para convertirlos en microbicidas (figura 1).
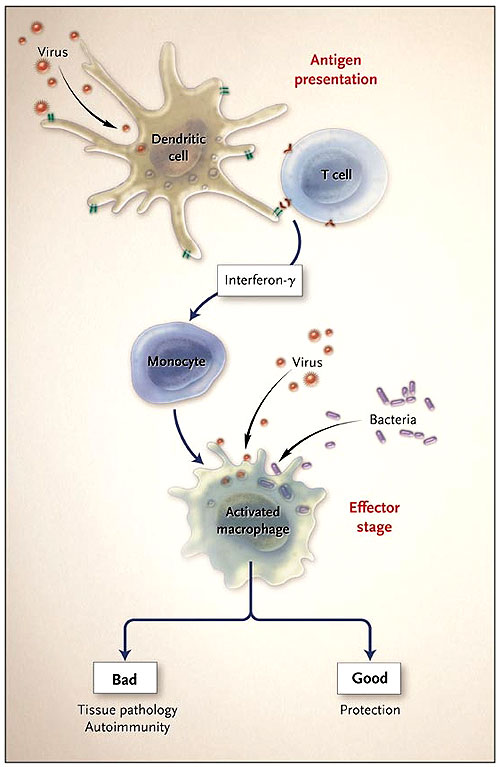
Barton y colaboradores describieron recientemente un efecto sorprendente de la infección del virus del herpes. Después de la infección inicial con uno de los dos herpesvirus murino, el virus entra en estado de latencia. En las primeras etapas de la infección, la inmunidad de las células T se desarrolla durante la presentación del antígeno; Las células T reconocen fragmentos peptídicos de los virus. Entonces, las células T liberan citoquinas, incluyendo interferón gamma, proteína clave que es activada por los macrófagos. Por un largo período, los macrófagos de los ratones infectados presentaron las características de la activación. Por consiguiente, la infección con un microorganismo sin relación (Listeria monocytogenes o Yersinia pestis) fue controlada con eficacia.
La protección cruzada realizada por los macrófagos activados va acompañada conjuntamente con potentes respuestas de las células T, lo que también se ha observado después de la infección con varios tipos de bacterias intracelulares así como con virus, incluyendo al virus de la coriomeningitis linfocítica y al virus ectromelia. Sin embargo, este tipo de protección no específica de los macrófagos debe ser distinguido de otros ejemplos de protección que impliquen reactividad cruzada de las células T o la activación de las células T de memoria, temas que han sido bien analizadas por Barton y colaboradores.
El principal foco de estudio del grupo de Erik S. Barton ha sido el efecto de la infección latente de dos herpesvirus, el gammaherpesvirus 68 y el citomegalovirus, en la protección cruzada de ratones. La infección por estos virus indujo un estado prolongado de activación del macrófago que protegía a los ratones de subsecuentes infecciones con L. monocitogenes o Yersinia pestis. Tal como los virus del herpes o el Epstein-Barr, estos dos virus entran en una etapa de latencia en la cual prácticamente no hay enfermedad evidente asociada a la infección. Después de sucedido el período de activación del macrófago aparece una corta pero explosiva activación del interferón gamma, en donde una protección cruzada más duradera sugiere que debe existir una fuente continua de estímulos antigénicos. Por lo tanto, o las células T reconocen productos virales de los genes expresados durante la latencia (tema polémico) o hay mini-episodios de reactivación vírica durante el estado latente (que es evidente en los pacientes seropositivos para el citomegalovirus debido a la presencia de células T CD8). Ambos escenarios deberían preservar un sistema activo de células T, que también mantendría la activación de los macrófagos. Los autores concluyeron que la latencia de los virus del herpes tiene cierto efecto beneficioso al mantener al sistema inmune en un estado de alarma.
Los resultados de este estudio conducen a una pregunta más general pero no menos fundamental: ¿es el sistema inmunológico el que se expone al mundo de los microorganismos para combatir mejor a los patógenos? Barton y sus colegas parecen pensar así, y nos impulsan a no ignorar la latencia de los virus o aquellos que son crónicamente persistentes ya que serían componentes muy importantes. Incluso se preguntan, provocativamente, si la eliminación de la infección del herpesvirus mediante la vacunación podría tener un efecto negativo en la protección no específica y así de paso, cuestionan el procedimiento.
En resumen, el sistema inmune y el mundo microbiano tienen una manera prudente y astuta de obrar de forma recíproca y de influenciarse, en ambas direcciones. Para unos, la flora microbiana intestinal modula los linfocitos y la respuesta inespecífica proporcionando una gran carga antigénica, que incluye moléculas inmunomoduladoras como los lipopolisacáridos. Como un sistema inmunológico madura apropiadamente y se desarrolla mejor para futuros desafíos antigénicos; la polémica hipótesis de la higiene propone que la mayor presencia de alergias en ciertas poblaciones es el resultado de la falta de infecciones microbianas. Por otra parte, un sistema inmune continuamente activado puede desencadenar respuestas aberrantes que requieren control, y trastornar el delicado equilibrio inmunológico entre la variada gama de protagonistas celulares, lo que podría generar etapas de autoreactividad y enfermedades. La naturaleza del patógeno, el grado y el sitio de la infección, y el acervo genético del anfitrión son variables que pueden influenciar un buen o mal resultado. Cueste lo que cueste, el estudio del grupo de Erik S. Barton nos plantea el desafío para examinar profundamente el sistema inmunológico, en donde muchos microorganismos viven mediante complejas relaciones con el hospedador.
Fuente bibliográfica
Viral infections and nonspecific protection--good or bad?
Emil R. Unanue, M.D.
Department of Pathology and Immunology, Washington University School of Medicine, St. Louis, USA.
N Engl J Med. 2007 Sep 27;357(13):1345-6


